Tabela de Conteúdo
- Introdução: O Paradigma da Hiperconectividade
- A Ciência das Redes na Epidemiologia Moderna
- Componentes da Modelagem de Dispersão de Doenças
- Fontes de Dados para Análise de Fluxos Aéreos
- Do Grafo à Predição
- O Modelo Metapopulacional e as Equações Diferenciais
- Ferramentas e Bibliotecas Essenciais (R e Python)
- Desafios e Considerações Éticas
- Conclusão
- FAQ
- Referências
Introdução: O Paradigma da Hiperconectividade
Em um mundo onde mais de 4 bilhões de passageiros cruzam os céus anualmente, a geografia tradicional deu lugar à topologia das redes. Para a epidemiologia, isso significa que a distância entre São Paulo e Luanda não é medida em quilômetros, mas no número de voos diretos e conexões diárias. A Modelagem de Dispersão de Doenças por rotas aéreas tornou-se a ferramenta mais poderosa para antecipar a próxima pandemia e estruturar respostas de saúde pública baseadas em evidências [1].
Neste post, vamos mergulhar nos aspectos técnicos de como transformar dados de tráfego aéreo em modelos preditivos de risco. Se você é estudante de pós-graduação ou profissional de saúde pública interessado em ciência de dados, este guia servirá como bússola para compreender como o código se encontra com a vigilância epidemiológica.
A Ciência das Redes na Epidemiologia Moderna
Para realizar a Modelagem de Dispersão de Doenças, primeiro precisamos entender que o sistema de transporte aéreo global é uma “Rede de Mundo Pequeno” (Small-World Network). Isso implica que qualquer aeroporto no mundo está a poucos “pulos” (conexões) de qualquer outro.
Os epidemiologistas utilizam a teoria dos grafos para mapear essa rede:
- Nós (Nodes): Representam os aeroportos ou cidades.
- Arestas (Edges): Representam as rotas de voo.
- Pesos (Weights): Representam o volume de passageiros ou a frequência de voos.
A importância de um nó na rede é medida pela sua centralidade. Um aeroporto com alta centralidade de intermediação (betweenness centrality) atua como uma ponte. Se um patógeno atinge um desses “hubs”, a probabilidade de dispersão global aumenta drasticamente, exigindo medidas de vigilância mais rigorosas nesses pontos específicos [2].
Componentes da Modelagem de Dispersão de Doenças
A construção de um modelo robusto de dispersão não depende apenas do tráfego aéreo, mas da integração de três camadas de informação:
- Camada Epidemiológica: Inclui parâmetros do patógeno, como o Número de Reprodução Básico (R0), período de incubação e taxa de transmissibilidade.
- Camada de Mobilidade: Dados brutos de itinerários de voos, capacidade das aeronaves e dados de conectividade entre cidades.
- Camada Demográfica: Densidade populacional nos destinos, imunidade prévia da população local e capacidade de resposta do sistema de saúde [3].
A interação entre essas camadas permite calcular a probabilidade de importação de um caso. Não se trata de saber se a doença chegará, mas quando e com que intensidade.
Fontes de Dados para Análise de Fluxos Aéreos
Para executar a Modelagem de Dispersão de Doenças, o acesso a dados de qualidade é o primeiro grande desafio. Epidemiologistas utilizam diversas fontes, cada uma com suas vantagens:
| Fonte de Dados | Descrição | Uso Principal |
| IATA / OAG | Dados comerciais de companhias aéreas. | Modelos de alta precisão com volume real de passageiros. |
| FlightRadar24 / OpenSky | Dados de telemetria de voos em tempo real (ADS-B). | Monitoramento de movimentação imediata e anomalias. |
| WorldPop / BioMosaic CDC | Integração de dados de mobilidade com demografia. | Estimativa de impacto em populações vulneráveis. |
| Humanitarian Data Exchange (HDX) | Dados abertos sobre infraestrutura de saúde. | Avaliação da capacidade de resposta no destino. |
A combinação desses dados permite que pesquisadores criem simulações estocásticas que consideram as incertezas inerentes ao comportamento humano e às mutações virais [4].

Do Grafo à Predição
Na epidemiologia, grafos são ferramentas matemáticas usadas para representar e analisar as relações entre indivíduos, locais ou eventos envolvidos na transmissão de doenças.
Em um grafo, cada nó (ou vértice) representa uma entidade — por exemplo, uma pessoa infectada, um domicílio, uma escola ou um aeroporto — enquanto as arestas (ligações) representam relações entre esses nós, como contato físico, convivência domiciliar ou deslocamento entre cidades.

Essa abordagem permite transformar informações complexas sobre contatos e interações em uma estrutura visual e analítica, facilitando a compreensão de como uma infecção pode se espalhar dentro de uma população.

O uso de grafos é especialmente importante para estudar cadeias de transmissão e redes de contato. Por exemplo, em um surto, um grafo direcionado pode indicar quem infectou quem, ajudando a identificar casos‑índice e possíveis superespalhadores.
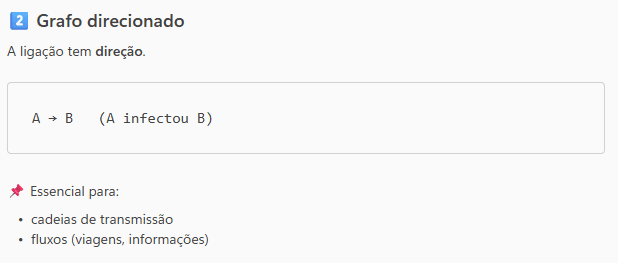
Já grafos ponderados podem representar a intensidade dos contatos, como a duração ou a frequência das interações, enquanto grafos temporais incorporam o momento em que os contatos ocorreram, aspecto fundamental para doenças infecciosas.
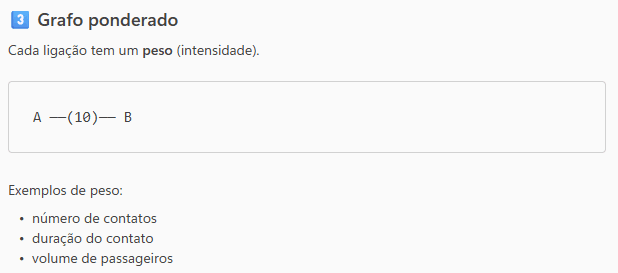
Essas representações são amplamente utilizadas em vigilância epidemiológica, investigação de surtos e modelagem da disseminação de doenças, apoiando decisões em saúde pública e estratégias de controle.

Abaixo, descrevemos o fluxo lógico (workflow) que um epidemiologista de dados segue para realizar uma Modelagem de Dispersão de Doenças.
1. Limpeza e Estruturação (Data Wrangling)
O primeiro passo é criar uma matriz de adjacência onde as linhas e colunas são os aeroportos e os valores são o fluxo de passageiros. Em R, o pacote dplyr é essencial para filtrar rotas relevantes.
2. Definição do Caso Índice
O modelo precisa de um ponto de partida. Por exemplo: “Um surto de febre hemorrágica identificado em Lagos, Nigéria”. O aeroporto de Lagos (LOS) torna-se o nó de origem com carga viral inicial.
3. Simulação de Propagação
Utiliza-se o algoritmo de Gillespie ou simulações de Monte Carlo para projetar a movimentação dos passageiros. Para cada passageiro que viaja de Lagos para Londres, há uma probabilidade P de ele estar infectado, baseada na prevalência da doença na origem e no tempo de voo [5].
4. Visualização e Análise de Risco
O resultado final é um mapa de calor ou um grafo dinâmico que mostra a evolução temporal da dispersão. Ferramentas como ggplot2 com sf ou bibliotecas de Python como Pyvis são amplamente utilizadas.
O Modelo Metapopulacional e as Equações Diferenciais
A base matemática da Modelagem de Dispersão de Doenças em rotas aéreas é frequentemente o modelo metapopulacional. Diferente de um modelo SIR simples (Suscetível, Infectado, Recuperado) para uma única cidade, o modelo metapopulacional conecta várias “subpopulações” por meio de termos de migração.

Essa equação demonstra que a dinâmica da doença em uma cidade é diretamente influenciada pelo fluxo de infectados que chegam das conexões aéreas [6].
Ferramentas e Bibliotecas Essenciais (R e Python)
Para colocar a Modelagem de Dispersão de Doenças em prática, o domínio de certas bibliotecas é fundamental.
No Ecossistema R:
igraph: Para análise profunda da estrutura da rede e cálculo de centralidade.epicontacts: Excelente para rastreamento de contatos e visualização de cadeias de transmissão.OutbreakTools: Facilita a integração de dados epidemiológicos, genômicos, filogenéticos, de contato e localização espacial.
No Ecossistema Python:
NetworkX: A biblioteca padrão para manipulação de redes complexas.straph: Para grafos temporais (onde as conexões mudam ao longo do tempo).PyRoss: Especializada em modelos epidemiológicos compartimentais estruturados, com uso de matrizes de contato e inferência avançada.Geopandas: Para manipulação de dados espaciais e coordenadas de aeroportos.
Dica de Expert: Ao modelar, lembre-se de que voos de longa distância (long-haul) têm dinâmicas diferentes de voos regionais devido ao tempo de exposição prolongado dentro da cabine [7].
Desafios e Considerações Éticas
A Modelagem de Dispersão de Doenças não é isenta de limitações. Um dos maiores desafios é o “atraso na notificação”. Modelos baseados em dados de 15 dias atrás podem não refletir a realidade de uma variante que se espalha rapidamente.
Além disso, há questões éticas essenciais:
- Privacidade: O uso de dados de telefonia para rastrear viajantes deve ser anonimizado e respeitar legislações como a LGPD.
- Estigma: Resultados de modelos que apontam certas regiões como “fontes” de infecção podem levar a restrições de viagem injustas e prejuízos econômicos severos.
- Equidade: Países com menor infraestrutura de dados podem ser excluídos dos modelos globais, dificultando sua preparação para crises [8].
O papel do epidemiologista é garantir que a modelagem sirva como ferramenta de proteção e não de exclusão.
Conclusão: A Ciência a Serviço da Vigilância
A Modelagem de Dispersão de Doenças por rotas aéreas representa a fronteira tecnológica da epidemiologia contemporânea. Ao transformar itinerários de voos em vetores matemáticos, conseguimos ganhar tempo — o recurso mais precioso em uma emergência de saúde pública.
Para recapitular os pontos que você não deve esquecer:
- A conectividade aérea transforma o mundo em uma pequena rede interconectada.
- Modelos metapopulacionais são a base para entender a troca de patógenos entre cidades.
- A centralidade de um aeroporto é um indicador de risco mais preciso do que sua localização geográfica.
- A integração de ciência de dados (R/Python) com epidemiologia clássica é o diferencial do profissional moderno.
A modelagem não substitui o trabalho de campo, mas orienta onde os recursos limitados da saúde pública devem ser alocados com prioridade.
FAQ: Perguntas Frequentes sobre Modelagem de Dispersão
1. É possível prever exatamente quando um vírus chegará a uma cidade?
Não exatamente. Modelos fornecem probabilidades e janelas temporais estimadas. A dispersão estocástica envolve o acaso, mas os modelos ajudam a reduzir a incerteza.
2. Como a modelagem lidou com as restrições de voo na COVID-19?
A modelagem mostrou que restrições de voo sozinhas apenas atrasam a disseminação, mas não a impedem, a menos que sejam acompanhadas de medidas locais rigorosas de testagem e isolamento.
3. Preciso ser um programador avançado para fazer essas modelagens?
Não necessariamente, mas é fundamental ter uma boa base em lógica de programação e bioestatística. Muitas bibliotecas hoje facilitam o processo, mas a interpretação dos resultados exige rigor científico.
4. Qual a importância dos dados genômicos nessa modelagem?
A epidemiologia molecular (filogeografia) permite confirmar as rotas previstas pela modelagem. Se o genoma de um vírus em Nova York é idêntico ao de um caso em Londres, os dados de voo confirmam a rota de dispersão.
5. Modelos de dispersão aérea funcionam para doenças transmitidas por vetores (como Zika)?
Sim. Nesse caso, modelamos o transporte do viajante infectado que, ao chegar ao destino, pode ser picado por um vetor local, iniciando um ciclo de transmissão autóctone.
Referências Bibliográficas
- Tatem, A. WorldPop, open data for spatial demography. Sci Data 4, 170004 (2017). https://doi.org/10.1038/sdata.2017.4
- Brockmann D, Helbing D. The hidden geometry of complex, network-driven contagion phenomena. Science. 2013;342(6164):1337-1342.
- Colizza V, et al. Predictability and epidemic pathways in global outbreaks of infectious diseases: the SARS case study. BMC Med. 2007;5:34.
- Khan K, et al. Global airspace connectivity and specific geographical vulnerability to the H5N1 avian influenza virus. PLoS One. 2009;4(6):e5967.
- Gillespie DT. Exact stochastic simulation of coupled chemical reactions. J Phys Chem. 1977;81(25):2340-2361.
- Balcan D, et al. Multiscale mobility networks and the spatial spreading of infectious diseases. Proc Natl Acad Sci U S A. 2009;106(51):21484-21489.
- Findlater A, Bogoch II. Human Mobility and the Global Spread of Infectious Diseases: A Focus on Air Travel. Trends Parasitol. 2018;34(9):772-783.
- Organisation for Economic Co-operation and Development (OECD). Recommendation of the Council on Health Data Governance. Paris: OECD Publishing; 2016. Available from: https://legalinstruments.oecd.org/en/instruments/OECD-LEGAL-0433
Pronto para colocar a mão na massa?! 🙂
Se gostou desse conteúdo, visite outros posts e compartilhe nosso site com seus pares!






